谈谈电池:究竟是什么限制了电池的容量?
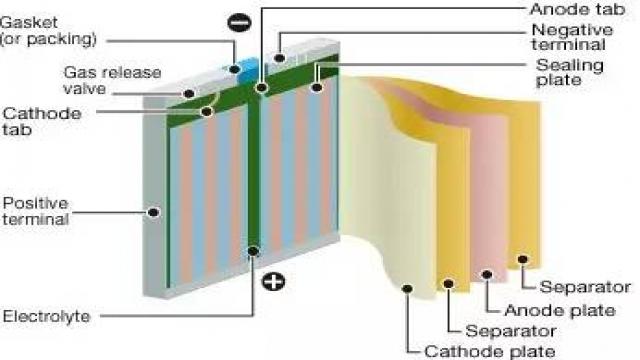
别走啊!!图看不懂可以听我归纳嘛。一般而言电池的四个部件非常关键:正极(放电为阴极),负极(放电为阳极),电解质,膈膜。正负极是发生化学反应的地方,重要地位可以理解。但是电解质有啥么用处??不做功还很占重量。接着看图。
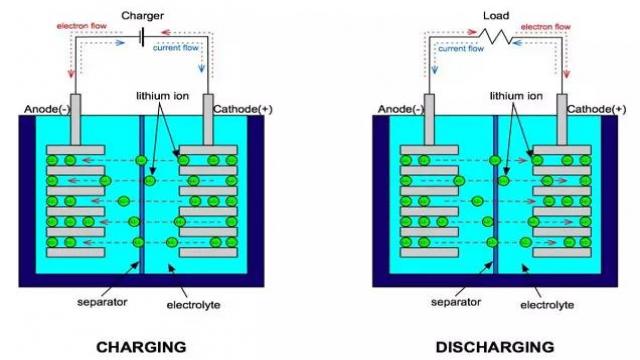
回来回来,看不懂图就听我讲,没点耐性上啥么模拟与电源社区?直接去天涯网易好了。
上图非常好地显示了电池充放电时的过程。这里先只说放电:电池内部,金属锂在负极失去电子被氧化,成为锂离子,通过电解质向正极转移;正极材料得到电子被还原,被正极过来的锂离子中和。电解质的理想作用,是运送且仅运送锂离子。电池外部,电子从负极通过外界电路转移到正极,中间进行做功。理想情况下,电解质应该是好的锂离子的载体,但绝不能是好的电子载体。因此在没有外界电路时,电子无法在电池内部从负极转移到正极;只有存在外界电路时,电子转移才能进行。
真晕,你不是说"能量载体们涉及到的具体化学过程千变万化,但总能归纳到一个氧化还原反应" "氧化还原反应的实质是电子从还原剂到氧化剂的转移",汽油车没有电解质吧?但是汽油燃烧也有电子转移吧,咋么就不能发电呢?
是的,燃烧必然涉及电子转移,那么燃烧的电子转移与电池的电子转移根本区别在哪里??
是否有序。
燃烧的电子转移在微观范畴上完全无序也不可控。我们完全没法预测燃料与氧气分子会往哪个方向运动,下一时刻的速率如何,我们也不知道燃料上的电子会向那个方向转移到哪个氧气分子上。10^20-23次方的分子的随机运动与更多的电子的随机转移导致的结果是无序的能量释放,或者简单点说,放热。
电池相比而言就好办点。尽管我们依旧不知道电池里面的每一个分子的运动轨迹,但我们至少可以知道:金属锂只会在负极材料表面失去电子成为锂离子;锂离子会从负极出发,最终到达正极。电子只会从负极材料表面出发,向着高电势的正极运动。10^20-23次方的电子的协同运动,在宏观上我们称之为,电流。
总结一下吧。为了放电,为了有序的电子转移,电池们不得不携带没有能量但是必不可少的电解质以及各种辅助材料,于是进一步降低了自身的能量密度。
这就完了么?没有。
老实说这一部分只是个铺垫,让有兴趣有耐心的人练练级,最终boss还没出现呢。
三:电池的大问题之二,负极表面材料
大家好,我又回来了。
如果你能坚持每行读下来一直读到这里,恭喜,你对电池的理解已经上了一个层次。
现在回顾上一部分的内容。啥么??全忘了??不就一句话么?由于不做功但是必不可少的电解质以及其他辅助材料的存在,电池的能量密度被稀释了。
这些额外重量到底有多少??
电解质的重量一般占电池全重15%(链接找不到了)隔膜没查到。估计把外壳,外接电极之类的辅助材料都算上,总重应该不超过电池总重的50%。
不对啊,电池虽然掺‘水’了,但也不至于水得如此啊。市面上的锂离子电池们的能量密度也就单质锂的1%左右。这到底又发生了什么?(这句式为何这么熟悉呢?)
让我们看看最常见的钴酸锂电池(Tesla Roadster)的电化学反应式。
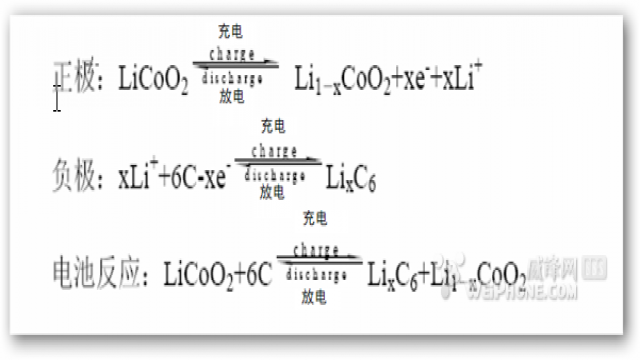
醒醒啊!!化学不好没关系,不要晕倒啊!!都读到这里了,你也知道达主会归纳的呀!!
发生电子转移的其实只是一部分锂与钴,其它的元素均不参与电子转移。
然后我们做个小计算:单质锂的原子量为6.9,能贡献1个电子参与电子转移。氧化剂来自空气,不需要考虑。
钴酸锂电池的电池反应的反应物总分子量为98+72=170,但只能贡献半个电子参与电子转移。因为只有部分锂原子会发生反应。
假如我们认为这两个电子的做功是一致的,那么就可以估计一下这两种能量载体的能量密度之比了。
电池能量密度:燃料能量密度=(0.5 /170) /(1/6.9) =2.03% 电池完败。
考虑到电池有一半重量是辅助材料,我刚才没算进去。于是还得打个折。就剩下1%了。
所以能量密度就成了这样:锂 43.1MJ/Kg 锂离子电池0.36~0.875MJ/Kg
现在你们是否明白 我为啥说:电池背后的化学限制了电池的能量密度。
接下来我们的问题是:为什么电池的化学反应要那么复杂,直接降低了电池的能量密度。
这个问题展开说会比较复杂,估计大部分人没耐心看完。所以先给个简单答案:
为了有序。
好了,没耐心的人,你们可以走了。下面真的很长,能读完的都不是一般人。
开始长篇之前再放张图:
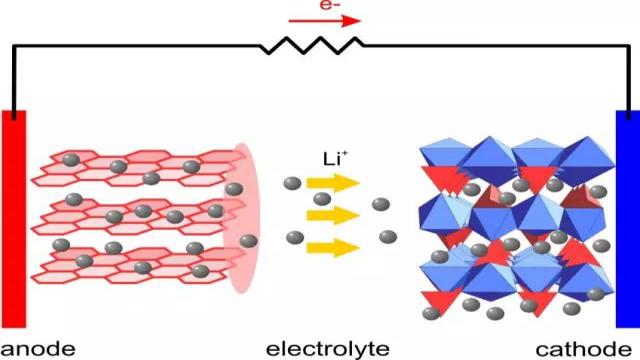
剩下的同学们,是不是觉得这图很熟悉?其实还是锂电池的示意图,只是这回因阴极阳极的表面结构都显示出来了。大家有没有觉得它们都很整齐规矩啊??
整齐规矩换个说法,有序。
为什么正极负极的表面结构都需要有序?因为要保证在充电/放电时,氧化还原反应只在正极和负极的表面发生,这样才能有电流。
我们先看石墨(C6)所在的负极。
负极的任务很简单,放电时保证锂原子(不是离子)都在负极表面失去电子,充电时再把它们抓回来就好了。由于充电时阳极电压低,带正电的锂离子会自发向负极移动,得到电子回归为锂原子。
似乎没有石墨什么事情啊??
如果是一次性电池,确实不需要石墨。但如果是可充放电池,阳极表面材料不是石墨也会是其它物质。
别卖关子了,快说到底咋回事??
急啥。这得仔细想想。充电时,锂离子会在负极表面得到电子成为锂原子。然后呢??
我们都知道 所有金属都是良好电子导体,锂是金属,所以锂是良好电子导体。于是先到负极的锂原子成为了负极的一部分,于是后到负极的锂离子加入了前锂的行列。。。。
于是完全由锂原子构成的晶体出现了。这个过程,又称析晶。结果是锂晶体会刺穿隔膜到达正极,于是电池短路报废了。
- 串连蓄电池组的均充技术研究 (11-30)
- 电动汽车电池管理系统的多路电压采集电路设计(11-30)
- 精确计算电池剩余电量至关重要(01-09)
- 针对便携式工业测量应用延长电池寿命的诀窍(01-10)
- 在多节电池组应用中使用DS2755电池电量计(01-16)
- 什么是光伏效应?(01-19)
