电位法测定酸度计的原理
时间:12-23
来源:互联网
点击:
(1)电位法测定pH值的理论 把一只对氢离子H+可逆的电极和一只参比电极放人到溶液中,就组成了一个原电池。
由于原电池中参比电极的电位在一定条件下是不变的,那么原电池的电动势就会随着被测溶液中氢离子的活度而变化。因此,可以通过测量原电池的电动势,进而计算出溶液的pH值。因氢离子选择电极符合能斯特方程,则电极电位为
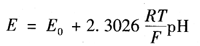
式中 Eo——氢电极的标准电位,规定该值等于0;
R——气体常数;
T——热力学温度;
F——法拉第常数。
式中,2.302,6RT/F被称为对氢离子可逆的电极理论电化转换系数。当被测溶液pH值变化1个单位时,由于R和F都是常数,因此电极电位就是温度的函数。
(2)电位法测定 pH值的实用定义 在测量溶液pH值的原电池中,由于参比电极的电位随温度变化而变化,使得无液界电位的原电池装置结构复杂,操作较困难。因此,pH值的测量实际上采用的是有液界的原电池,也就是说,用已知标准pHs值溶液测定未知pHx值的溶液。
当被测溶液为已知pH.标准溶液时,原电池电动势为
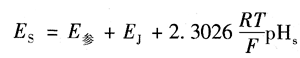
当被测溶液为未知的pH,时,原电池电动势为
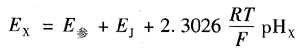
其中,E参是参比电极电位;Ej是指示电极电位。
若两次测定中E参和E,均保持不变(测定中,一定条件下E参是不变的,E参的变化很小),则有:
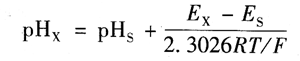
上式称为pH的实用定义,由此可以看出,pHs标准溶液是测量的基准。
电位法酸度 相关文章:
- 频宽、取样速率及奈奎斯特定理(09-14)
- 为什么要进行信号调理?(09-30)
- IEEE802.16-2004 WiMAX物理层操作和测量(09-16)
- 为任意波形发生器增加价值(10-27)
- 基于PCI 总线的高速数据采集系统(09-30)
- 泰克全新VM6000视频测试仪助力数字电视等产品测试 (10-06)
